亮点评述
【化工进展】西安交通大学等 | 张爱京,王桢钰,冯江涛,等:新型汞离子吸附材料研究进展
新型汞离子吸附材料研究进展
张爱京1,王桢钰1,肖宁宁2,宋艳娜1,李军3,冯江涛1,延卫1
1西安交通大学能源与动力工程学院,西安市固体废物资源化利用重点实验室,陕西 西安 710049;2西安交通大学人居环境与建筑工程学院,陕西 西安 710049;3渭南市环境科学研究中心,陕西 渭南 714000
引用本文
张爱京, 王桢钰, 肖宁宁, 等. 新型汞离子吸附材料研究进展[J]. 化工进展, 2025, 44(2): 899-913.
✦
DOI:10.16085/j.issn.1000-6613.2024-0153

摘要
汞污染来源广泛、排放量大,已成为世界上最严重的十大污染源之一。在众多汞离子去除技术中,吸附法由于具有高效且经济的特点,成为了较为成熟且应用广泛的处理技术。性能优异的吸附剂是吸附法的关键,而传统的吸附材料吸附性能有限。基于此,本文介绍了近年来报道的金属有机骨架材料(MOFs)、共价有机框架材料(COFs)、共轭微孔聚合物(CMPs)、导电聚合物、二维过渡金属碳(氮)化物(MXenes)和复合材料等新型汞离子吸附材料,详细论述了这些吸附材料的结构特征及其与汞离子的吸附特性之间的关系。总结了水中汞离子吸附材料的发展前景,指出调节材料结构以及添加特定官能团是进一步研发新材料的方向,希望对新型汞离子吸附材料的设计和开发提供一定参考和启发。
近年来,环境污染问题越来越受世界各国关注,其中重金属污染问题尤为突出。由于重金属离子具有高毒性且不可降解,世界各国已出台相关政策以加强对重金属离子管理。其中,汞污染来源广泛、排放量大,不仅地壳运动、火山喷发等自然活动会产生大量的汞,采矿、冶金等人为活动也会排放大量的含汞废水进入自然水体中。汞污染已经成为世界上最严重的十大污染之一。在天然水体中,汞主要以零价单质汞、汞离子的无机形式和有机化合物的形式存在,多种形态之间能够相互转化,并通过水、气和生物进行迁移。汞离子是其在水体中主要的存在形态。汞离子具有很强的毒性,并且可以通过食物链和食物网富集,对人体产生不可逆转的损伤。世界卫生组织(World Health Organization,WHO)和美国国家环境保护局(United States Environmental Protection Agency,USEPA)分别规定,饮用水中汞的浓度不能超过1μg/L和2μg/L。因此,寻找高效的汞离子污染去除技术迫在眉睫。
目前,含汞废水的处理方法主要有物理化学法(包括化学沉淀和离子交换)、电化学法、生物法、吸附法。各处理方法的优缺点,如表1所示。其中,吸附法因具有廉价、工艺简单以及可进行深度处理等特点,成为了目前处理含汞废水应用较为广泛且成熟的方法。
表1 水体中汞离子处理方法优缺点对比
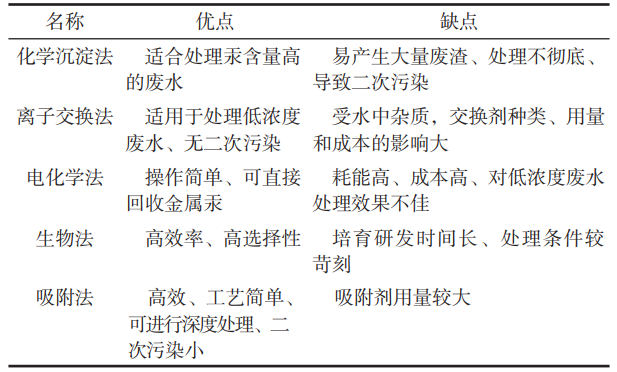
性能优异的吸附剂是吸附法的关键。传统的吸附剂主要有沸石、分子筛等无机材料,纤维类、树脂类等有机高分子材料以及活性炭类材料。然而,这些传统吸附剂都存在吸附容量不高、吸附平衡时间较长且选择吸附性能较差等缺点。因此,研究开发吸附容量大、吸附速率高、选择吸附性能好且稳定性好的吸附剂便成了吸附法的关键。
近年来,一系列新型吸附材料逐渐被研发出来。主要包括金属有机骨架材料(MOFs)、共价有机框架材料(COFs)、共轭微孔聚合物(CMPs)、导电聚合物、二维过渡金属碳(氮)化物(MXene)和复合材料(图1)。本文对以上新型材料的结构及其吸附汞离子的性能进行系统介绍(优缺点见表2),并总结提升吸附剂性能的方法,希望对新型吸附剂的开发及其应用于水体中汞离子污染的处理具有一定的借鉴意义。
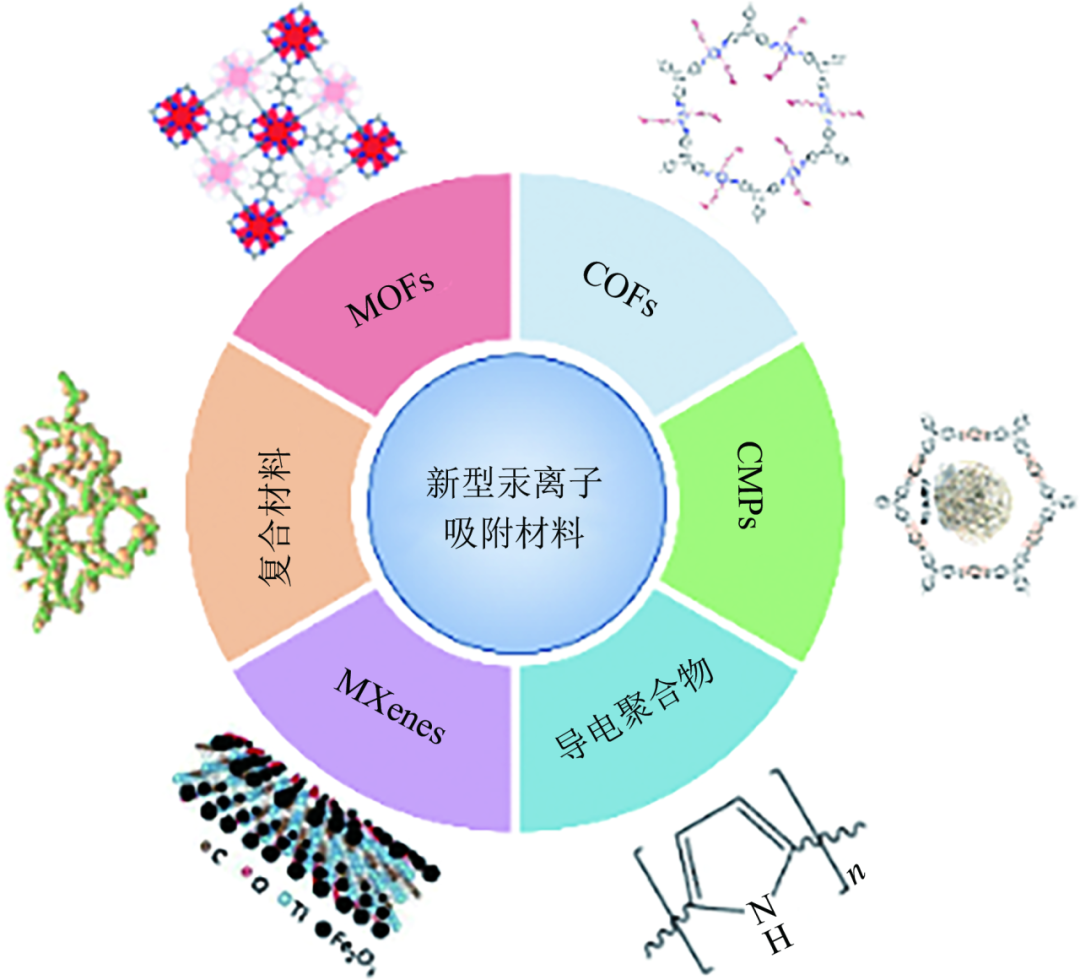
新型汞离子吸附材料分类
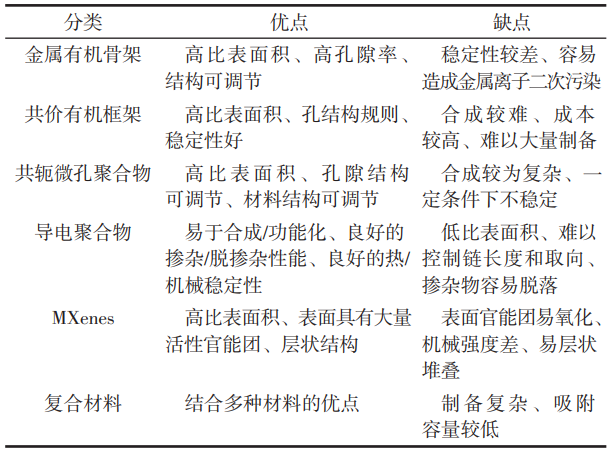
表2 不同类型材料优缺点对比
01
金属有机骨架材料
金属有机骨架材料是金属有机材料中的一个重要子类,是一种新型材料。MOFs通过共价键(配位键)将有机配体和中心金属离子连接,实现了无机相和有机相的结合,具有超高孔隙率(高达90%的自由孔体积)和比表面积(理论上可达14600m2/g),因此具有作为各种环境污染物(包括水中的重金属)高效吸附剂的潜力。
按组分单元和合成方法的不同可以将MOFs材料主要分为以下几类:①等网状MOFs(IRMOFs);②拉瓦锡骨架材料(MILs);③类沸石咪唑骨架材料(ZIFs);④孔-通道式骨架材料(PCNs);⑤UiO系列金属有机骨架材料(UiO系列MOFs)。其中,IRMOFs主要用于有机物吸附,PCNs主要用作催化材料,这里不进行探讨。3种用于汞离子吸附的MOFs材料优缺点见表3。
表3 不同MOFs材料优缺点对比

1.1 拉瓦锡骨架材料
拉瓦锡材料是最受欢迎的MOFs系列之一,是Hg(Ⅱ)的理想吸附剂。最早的MIL是由Ferey及其拉瓦锡材料研究所的同事采用苯二甲酸和铬的三聚八面体簇制备的MIL-101,MIL就是由该机构的缩写命名的。溶剂热法是合成MILs最常用的方法,该方法合成的MILs具有尺寸均匀、结晶度好、拓扑形貌可调节等优点。此外,由于其发达的孔隙结构和高的比表面积,材料的吸附位点得以充分暴露,有利于汞离子在材料上的快速吸附。起初,MILs主要是通过将中心金属与有机磷酸或琥珀酸连接合成的。经过不断研究,目前MILs通常由羧酸盐和三价阳离子组成。至今为止,已经开发的MILs主要有以Gr、Fe、Al为中心原子的MIL-100、MIL-101和MIL-53。除此以外,还有以Fe为中心原子的MIL-88A、MIL-88B,以Ti为中心原子的MIL-125,以及以In、Ga、Fe或V为中心原子的MIL-68等。有些MILs已被用作吸附剂去除包括重金属离子在内的不同类型的污染物。
虽然部分基础MILs材料已经用于Hg(Ⅱ)吸附去除,但是并没有表现出好的去除效果。而改性后的MILs对吸附性能有明显的提升。尤其是含S的基团(如巯基)和含N的基团(如氨基)都表现出与水中Hg(Ⅱ)较强的相互作用,因此它们经常被引入MILs以增强其对Hg(Ⅱ)的吸附效果。Zhang等合成了一系列具有不同中心金属离子(Al3+、Cr3+、Fe3+和Ti4+)的氨基功能化MILs[图2(a)]。经过氨基功能化后,所有的MILs对Hg(Ⅱ)的吸附效果都有提升。其中,NH2-MIL-53(Al)表现出最高的Hg(Ⅱ)吸附容量(153.9mg/g),同时能在60min内达到吸附平衡,这是由氨基与水中Hg(Ⅱ)之间强相互作用导致的。NH2-MIL-53(Al)使用0.1mol/L的盐酸和10%硫脲混合溶液进行脱附,4次循环后,吸附容量下降不到10%。原始的MIL-101对Hg(Ⅱ)的吸附容量为75.0mg/g,而用巯基修饰后的SH-MIL-101[图2(b)]对Hg(Ⅱ)的吸附容量为250.0mg/g,且能够在20min内达到吸附平衡,吸附速率常数为6.61×10-2g/(mg·min)。用0.01mol/L的盐酸和0.1%硫脲混合溶液进行脱附,仅5次循环后,去除率就由原先的95%下降到了80%。同样的,用巯基修饰的MIL-88A对Hg(Ⅱ)的吸附容量由333.3mg/g提升到了1111.1mg/g。Li等分别用巯基和氨基修饰了MIL-68(In),发现SH-MIL-68(In)对Hg(Ⅱ)吸附容量为450.0mg/g[图2(c)],在2min内能够去除超过98%的Hg(Ⅱ),吸附速率常数达到1.25g/(mg·min),而NH2-MIL-66(In)的Hg(Ⅱ)吸附容量仅为50.0mg/g。这主要是由于巯基是软碱性基团,与软酸性的汞离子之间具有强作用力[图2(d)],两者之间能够牢固结合。由此可知,含巯基和含氮官能团修饰MILs均能够提高材料本身的吸附性能,其中巯基与汞离子具有更高的亲和力,有利于提高材料的吸附性能。

拉瓦锡骨架材料(MILs)吸附Hg(Ⅱ)
1.2 类沸石咪唑骨架材料
类沸石咪唑骨架作为金属有机骨架的一个子类,具有高孔隙率、高比表面积(通常可达到1000~10000m2/g)、可调的表面性能以及优异的机械稳定性,化学稳定性和热稳定性。在结构上,ZIFs是四面体键合金属离子(T)与咪唑酸酯及其衍生物(Im)之间通过配位作用,形成T(Im)2的结构。咪唑盐在桥接过渡金属时形成的T—Im—T键角与沸石中的Si—O—Si键角相接近(145°),这就使得许多ZIFs具有了不同的沸石状拓扑结构。ZIFs的合成基本上取决于金属离子与有机连接体之间的配位能力,这使其比传统沸石具有更大的灵活性和可控性。截至目前,已有超过90种ZIFs结构被报道,其中一些结构与沸石具有相同的拓扑结构,而另一些结构显示出与沸石不同的晶体结构。
到目前为止,增强ZIFs的功能性的方法主要有:接枝功能化[通过合成后修饰(PSM)或溶剂辅助配体交换(SALE)也称为合成后交换(PSE)]、金属和金属氧化物纳米颗粒(NPs)的封装以及生物分子的封装。Liu等基于离子交换机制和络合机制,制备了一种在滤纸上原位生长的新型单片吸附材料ZnS-ZIF-8,对废水中Hg(Ⅱ)的吸附容量为925.9mg/g,并且经硫化钠清洗后即可实现脱附回收。Zhou等合成了一种钴基ZIF-67,Hg(Ⅱ)通过与咪唑环上的氮配位,并取代ZIF-67中的Co(Ⅱ)而被吸附[图3(a)]。ZIF-67对Hg(Ⅱ)的吸附容量达到了1740mg/g,且在120min内对100mg/L的Hg(Ⅱ)去除率可达99%。此外,由于钴离子的流失,样品的颜色会由紫色褪为白色,能够直观判断吸附剂是否达到吸附饱和。Li等采用一步法合成了ZIF-8[图3(b)],Hg(Ⅱ)通过取代其中的Zn(Ⅱ),与二甲基咪唑形成更加稳定的金属配体配合物,对Hg(Ⅱ)的吸附容量达到了2195.1mg/g。同时,ZIF-8能够对汞离子进行快速吸附,在不同的汞离子浓度下,均能够在10min内达到吸附平衡,去除率达到99%以上。用0.1mol/L盐酸进行脱附,5次循环后,Hg(Ⅱ)去除率仍保持在86.25%。除此以外,ZIF-8与甘蔗渣(SCB)相结合,可以很好地解决在实际应用中的回收问题。
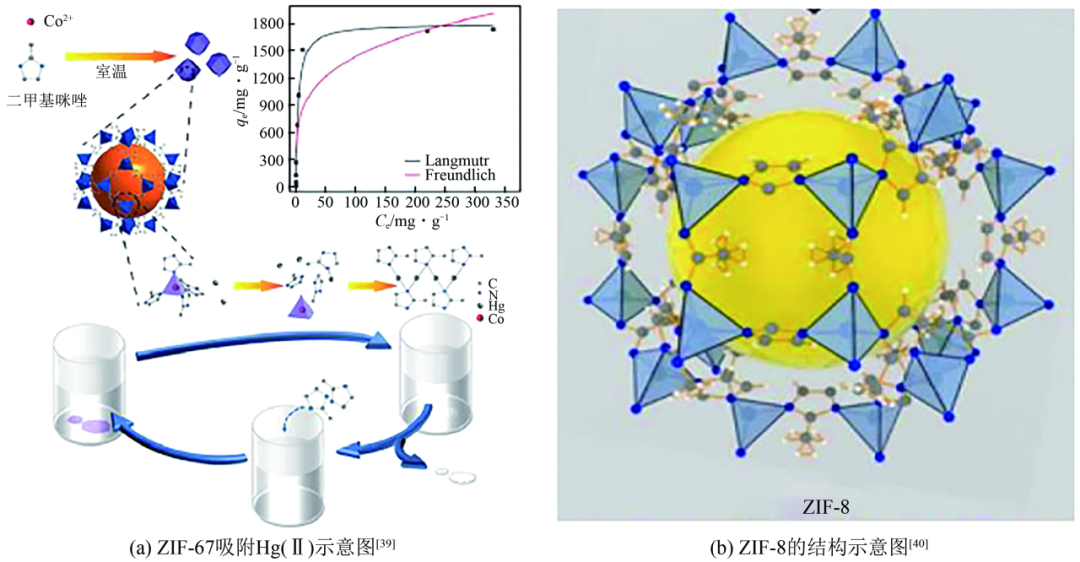
类沸石咪唑骨架材料(ZIFs)吸附Hg(Ⅱ)
1.3 UiO系列金属有机骨架材料
UiO系列金属有机骨架材料是一种刚性金属有机骨架材料,除了具有MOFs普遍的优点外,还具有良好的热稳定性和化学稳定性。UiO系列MOFs最早是由Lillerud课题组合成,其名字是奥斯陆大学(University of Oslo)的缩写。这种材料以Zr为中心金属、羧酸盐(如对苯二甲酸)为有机配体组合形成,具有规则的网状结构。合成过程中改变连接剂的种类以及连接剂所具有的官能团类别,能够在UiO材料上添加特定的目标官能团,进而提高UiO材料与汞离子之间的亲和力。除此以外,利用分子调节剂(如盐酸或一元羧酸等),可以在材料中产生连接剂或团簇的缺失,生成缺陷型的UiO系列MOFs。从而增加材料的比表面积,暴露出更多的Hg(Ⅱ)结合位点,提高汞离子的吸附容量。UiO材料中的缺陷位点还能够增加孔隙体积,使Hg(Ⅱ)在材料中的扩散更加迅速,进而提高吸附速率,缩短达到平衡所需要的时间。
在众多的UiO系列MOFs中,UiO-66是报道最早和研究最为广泛的锆基金属有机骨架材料之一(图4),具有优异的稳定性。因此,对UiO-66进行改性受到了大量的关注和研究。例如,Li等用巯基修饰UiO-66(UiO-66-SH)[图5(a)],其对Hg(Ⅱ)的吸附容量为785mg/g[图5(b)]。此外,UiO-66-SH还具有较高的吸附速率,准二级动力学常数达到了3.4×10-2g/(mg·min)。其在多种二价阳离子干扰的情况下,对Hg(Ⅱ)的去除效果没有明显变化,用0.01mol/L的盐酸和0.1%的硫脲混合溶液进行脱附,能够在7次循环之后,仍然具有90%以上的汞离子吸附容量。Fu等采用2,5-二巯基-1,3,4-噻二唑对UiO-66-NH2进行巯基功能化(UiO-66-DMTD)[图5(c)],巯基和含氮基团通过与Hg(Ⅱ)络合,对水中Hg(Ⅱ)的吸附容量为670.5mg/g[图5(d)],同时在连续10次循环后去除率仅下降13.5%。Hg(Ⅱ)对其他金属离子的分离因子αihg都达到190以上[αihg大于1,说明吸附剂会优先去除Hg(Ⅱ)]。Chai等利用4,6-二氨基-2-巯基嘧啶对UiO-66进行功能化改性(UiO-66-DMP),汞离子通过与UiO-66-DMP上的N原子、S原子之间的螯合作用被吸附。采用1%硫脲与0.1mol/L的盐酸混合溶液作为解吸剂,经过5次循环后,材料对汞离子的去除率由95.97%降到了85.42%。
UiO-66材料结构图
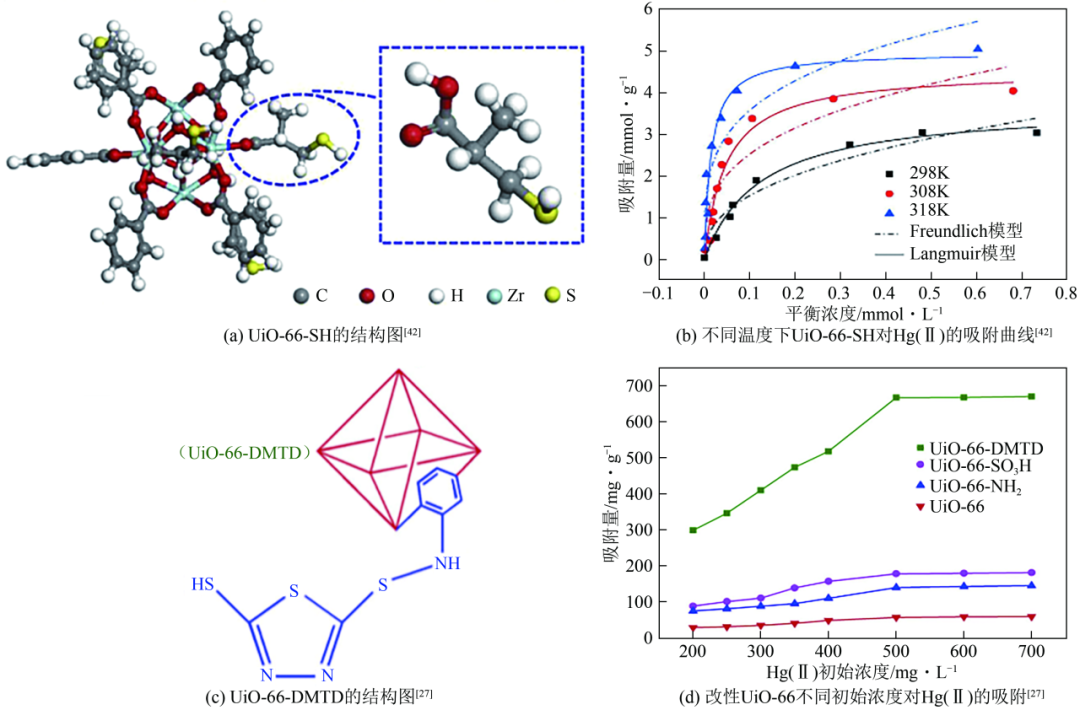
UiO系列MOFs吸附Hg(Ⅱ)
但是,MOFs材料自身也存在缺点,如结构容易塌陷、容易产生金属离子二次污染、在溶液中材料稳定性较差等。这些缺点也影响了MOFs材料在实际中的应用。如何提高MOFs材料的稳定性,是MOFs材料面临的最为严峻的问题之一。根据路易斯酸碱理论,在合成过程中选择羧酸基配体(硬路易斯碱)和高价金属离子(硬路易斯酸),或者偶氮酸配体(软路易斯碱)和低价过渡金属离子来构建金属有机骨架材料,能够很好地增强MOFs材料的稳定性。还可以利用合成后修饰的方法,在MOFs的骨架上进行接枝反应,引入低表面能基团作为保护剂,提高MOFs材料的稳定性。
02
共价有机框架材料
共价有机框架材料是一种新型多孔有机晶体材料,是通过共价键对轻元素进行热力学控制的可逆聚合形成的。人为设计可以将有机单元精确集合到COFs上。COFs由不同的刚性单体组成,刚性单体的不同几何配体形成了不同多边形骨架的拓扑结构。这就使得其具有高度可调节的分子结构、高孔隙率以及合适的孔径大小,能够使汞离子更加顺利地在材料孔隙内通过,提升吸附速率。在合成过程中合理设计,就能够在暴露出更多活性吸附位点的同时,添加不同的活性官能团,增强材料与汞离子之间的亲和力,进而提升材料的吸附性能。与传统材料相比,COFs具有密度低、化学稳定性好、孔结构规则和比表面积大等特点。因此,其在解决当前与能源和环境可持续性相关的问题方面具有良好的前景,应用在气体吸附、光电子、催化、质子传导等领域。此外,COFs有机单元的可调节性有助于解决有毒重金属引起的环境问题。根据合成单元的不同结构,COFs可分为二维(2D)COFs和三维(3D)COFs。2D COFs相较于3D COFs更为常见,其具有大比表面积的层状结构,活性官能团之间能够彼此接近,以促进协同作用,进而增强了COFs与吸附质之间的亲和力。因此,其更具有作为优秀吸附剂的潜力。
自2005年第一次报道COFs以来,与“共价有机框架材料”相关的文章数量逐年增加。虽然COFs在环境修复方向的探索相对较晚,在2016年才报道了第一个COFs型吸附剂/化学传感器。但是其发展速度却非常快,已经吸引了众多的科学研究者进行共价有机框架吸附材料的研究。如Sun等在2017年通过1,2-乙二硫醇处理COF-V合成的材料(COF-S-SH)[图6(a)]对水溶液和空气中的汞都有很好的吸附效果,对Hg(Ⅱ)的吸附容量达到了1350mg/g。更重要的是,COF-S-SH的分配系数(Kd)高达2.3×109mL/g,能够在10min内达到99.94%的吸附去除率,将水中Hg(Ⅱ)浓度从5mg/L降为0.73μg/L以下,3h内降至0.1μg/L,远低于饮用水的可接受限值(2μg/L)。初始吸附速率h(k2qe2)高达143mg/(g·min)。这主要是因为COF-S-SH具有大量的Hg(Ⅱ)吸附位点,同时良好的孔隙结构促进了汞离子在材料孔道内的扩散。同样的,Ma等通过Schiff反应,用巯基功能化COF-1合成了COF-SH[图6(b)],对Hg(Ⅱ)的吸附容量达到了1283mg/g,是不含巯基的COF-1吸附容量(53.1mg/g)的24倍以上。COF-SH在30min内对Hg(Ⅱ)的去除率为95%以上,在120min内去除率为99%以上并达到吸附平衡。用0.5mol/L的盐酸进行脱附再生,经过10次循环之后,其吸附容量仍然保持在初始值的97%以上。Qian等以硫脲作为连接子制备出了两种不同孔隙结构的COFs(JNU-3和JNU-4)。拥有更高硫脲含量的JNU-3吸附容量达到了960mg/g,明显高于JNU-4的561mg/g。JNU-3能够在10s内将Hg(Ⅱ)浓度由10mg/L降低到0.002mg/L,达到吸附平衡。类似的,Hussain等通过同样的反应,分别在90℃和120℃条件下利用三醛基间苯三酚(TP)和硫代卡巴肼(Tch)合成了具有更高硫脲含量且具有酮和烯醇互变异构体的TpTch-90和TpTch-120[图6(c)]。两种材料对汞离子的吸附容量分别达到了4270mg/g和4277mg/g。TpTch-120比TpTch-90具有更多的酮式结构,而酮式结构与Hg(Ⅱ)有较高的配位能力,同时Hg(Ⅱ)的吸附会促进酮式结构的形成。因此,TpTch-90和TpTch-120分别在10min内脱除了90%和99%的Hg(Ⅱ),并在在20min和30min内达到吸附平衡,TpTch-120比TpTch-90表现出更高的吸附速率。
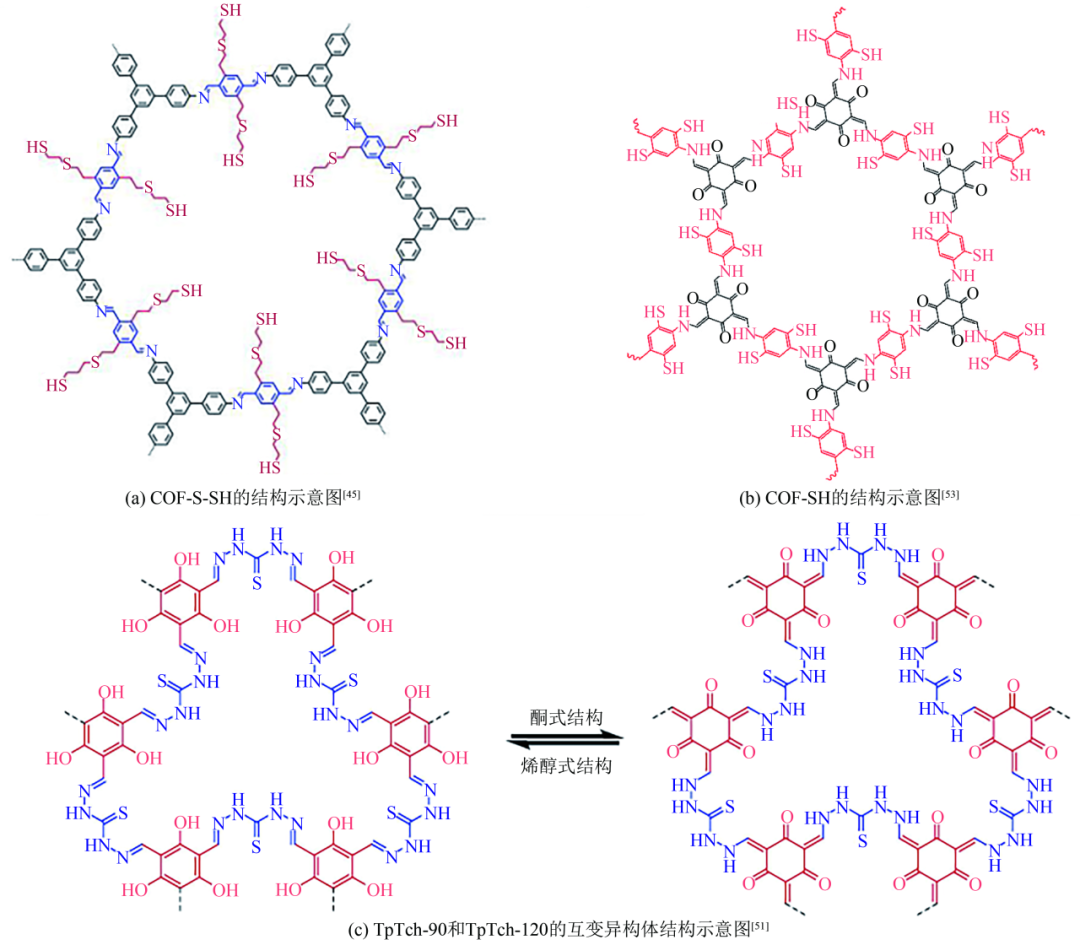
共价有机框架(COFs)材料的结构示意图
然而,共价有机框架也存在有一定的不足。多数COFs合成方法的反应条件苛刻、操作难度大、生产成本高、无法大量制备和工业化应用,这都影响着COFs材料的发展。因此就需要开发出更为简便的合成技术,提高COFs材料的纯度以及实现大规模生产,以促进COFs材料的工业化应用。
03
共轭微孔聚合物
共轭微孔聚合物是一类由有机构筑单元通过共价键组装成的具有π-π共轭体系的多孔聚合物。该类聚合物具有大量固定的永久微孔的三维共轭网络结构,且可以按照框架化学实现分子水平的精准设计与合成。首次关于CMPs的报道在2007年,由炔基芳烃单体与含卤素芳烃的Sonogashira-Hagihara交叉偶联成功合成了微孔聚(亚芳基亚乙炔)网络,其比表面积高达834m2/g。由此可见,与常见的材料相比,CMPs具有更高的比表面积。除此以外,CMPs的结构和孔径可以进行调节和设计,这就为CMPs的孔径和结构设计与可控调节提供了可能。高比表面积和适宜的孔隙结构,能够使CMPs具有更多的汞离子吸附位点以及更高的扩散速率,Hg(Ⅱ)在快速到达吸附位点的同时能够与之牢固结合,导致CMPs具有非常高的吸附容量和吸附速率。
自CMPs被发现以来,就得到了迅速发展。在2015年Xiang等合成了一种超交联共轭微孔聚合物(HCMP-1),其比表面积为432m2/g,对Hg(Ⅱ)的吸附容量达到了604mg/g。除此以外,HCMP-1具有较好的荧光性质[图7(a)],在吸收Hg(Ⅱ)后荧光明显减弱。其作为汞离子检测荧光探针,具有高灵敏度,对Hg(Ⅱ)的检测极限低至5×10-8mol/L。2021年Lou等在共轭微孔聚苯胺(CMPAs)中设计了杂化分子孔合成CMPA-M,其对Hg(Ⅱ)吸附容量达到了975mg/g,同时具有高吸附速率,对初始浓度为50mg/g的Hg(Ⅱ)溶液可以在48s内去除94.8%,初始吸附速率高达113mg/(g·min)。2023年,Wang等用三(4-溴苯基)胺分别与三(4-氨基苯基)胺(TAPA)、对苯二胺(PDA)、4,4'-二氨基二苯胺(DDA)合成了3种不同的氮基共轭微孔聚合物。其中CMPPDA[图7(b)]对Hg(Ⅱ)的最大吸附容量为1582.6mg/g[图7(c)];CMPDDA有效地将Hg(Ⅱ)浓度从11.2μg/L降至0.01μg/L以下。同时,3种材料均具有优异的吸附再生性能,能够在至少25次循环中保持90%以上的吸附容量,材料主要通过N原子与Hg(Ⅱ)之间形成螯合吸附[图7(d)]达到去除Hg(Ⅱ)的目的。
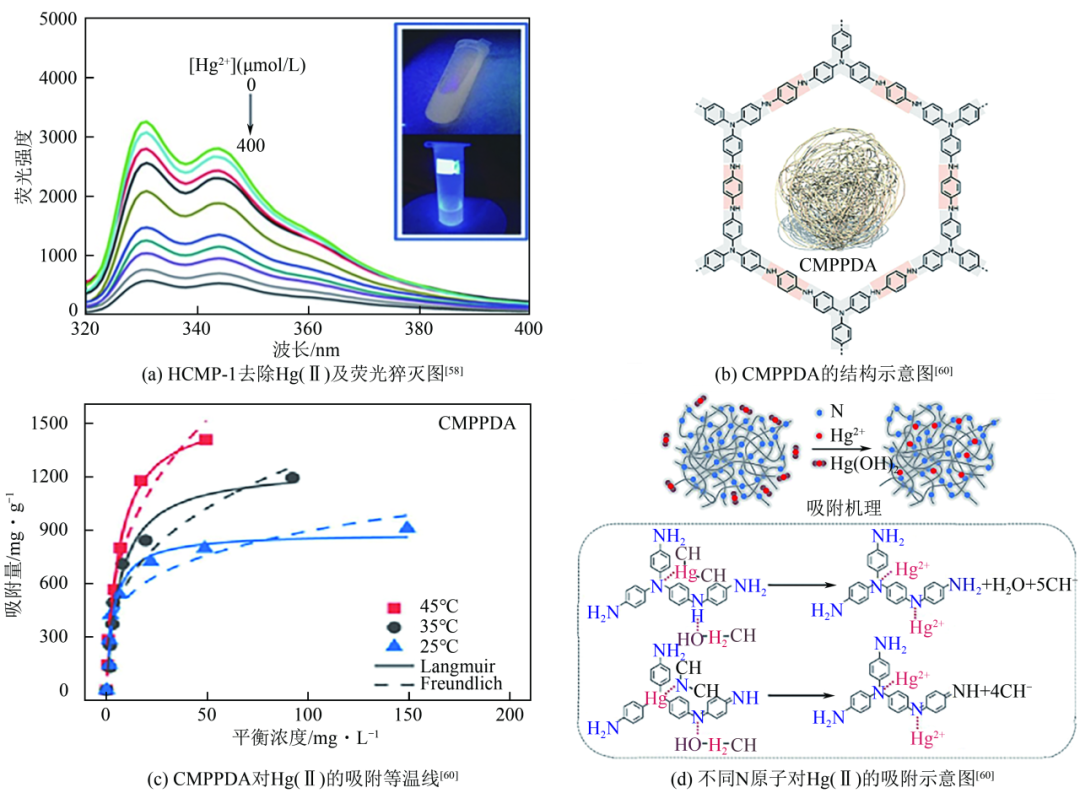
共轭微孔聚合物吸附Hg(Ⅱ)
共轭微孔聚合物往往合成过程较为复杂,需要特殊的合成策略和条件,影响了CMPs的规模化生产和利用。此外,CMPs的共轭结构在一些条件下并不稳定(如在氧化性环境中发生分解、高温下结构被破坏等),因此在长期的汞离子吸附-解吸过程中,可能会出现吸附效果下降的情况。要推动CMPs的快速发展,就需要在合成阶段选择简便且成本低的合成方法和条件,降低合成的难度和成本;同时选择合适的单体并设计出稳定性较高的结构,增加材料的稳定性。
04
导电聚合物
导电聚合物是主链具有π共轭电子体系,通过掺杂达到导电态的高分子材料。常见的导电聚合物有聚吡咯、聚呋喃、聚苯胺、聚噻吩等。与传统材料相比,导电聚合物具有易于合成/功能化、良好的掺杂/脱掺杂性能、良好的热/机械稳定性、化学通用性、物理可调节性和高活性以及成本低等特点。因此,导电聚合物是吸附重金属的最佳吸附剂之一。
导电聚合物主链中N原子和S原子的存在是其对污染物发生吸附的主要原因。导电聚合物的吸附机制可能有静电吸引、π键相互作用、螯合和离子交换。利用分子间掺杂的方式,能够显著提高导电聚合物对重金属离子的吸附选择性、提高吸附容量。Das等用巯基乙酸掺杂聚吡咯获得了巯基功能化的聚吡咯(PPy/MAA),通过巯基与Hg(Ⅱ)结合[图8(a)],在25℃时对汞的吸附容量达到了1736.8mg/g。Ballav等利用半胱氨酸掺杂的聚吡咯(PPy@L-Cyst)主要通过富电子官能团(—SH、—NH2和—COOH)静电相互作用吸附Hg(Ⅱ),在25℃时对水体中Hg(Ⅱ)的最大吸附容量能够达到2042.7mg/g。此外,导电聚合物还具有一系列的衍生物,如聚吡咯甲烷(吡咯与醛类聚合而成)。在合成过程中改变醛的种类,选择特定官能团的醛类,能够人为地添加与汞具有高亲和力的官能团,从而提升导电聚合物对汞离子的吸附性能。Guo等通过氯功能化聚吡咯甲烷(PPyCE),其在室温下对Hg(Ⅱ)的吸附量达到了684.59mg/g,远高于未功能化的聚吡咯甲烷(122.74mg/g)。采用0.1mol/L的盐酸和1%的硫脲混合溶液进行脱附再生,经过5次再生循环后,吸附容量仍保持在原来的80%以上。Wang等通过苯基羧基修饰聚吡咯甲烷(PPD4CBA)主要通过苯环上的羧基与Hg(Ⅱ)进行螯合[图8(b)],不仅吸附容量达1400mg/g以上,而且能够在100min内将10.8μg/L极低浓度的汞吸附去除92.5%,经10次吸附-解吸循环后,PPD4CBA仍能保持原在吸附容量的85%左右。
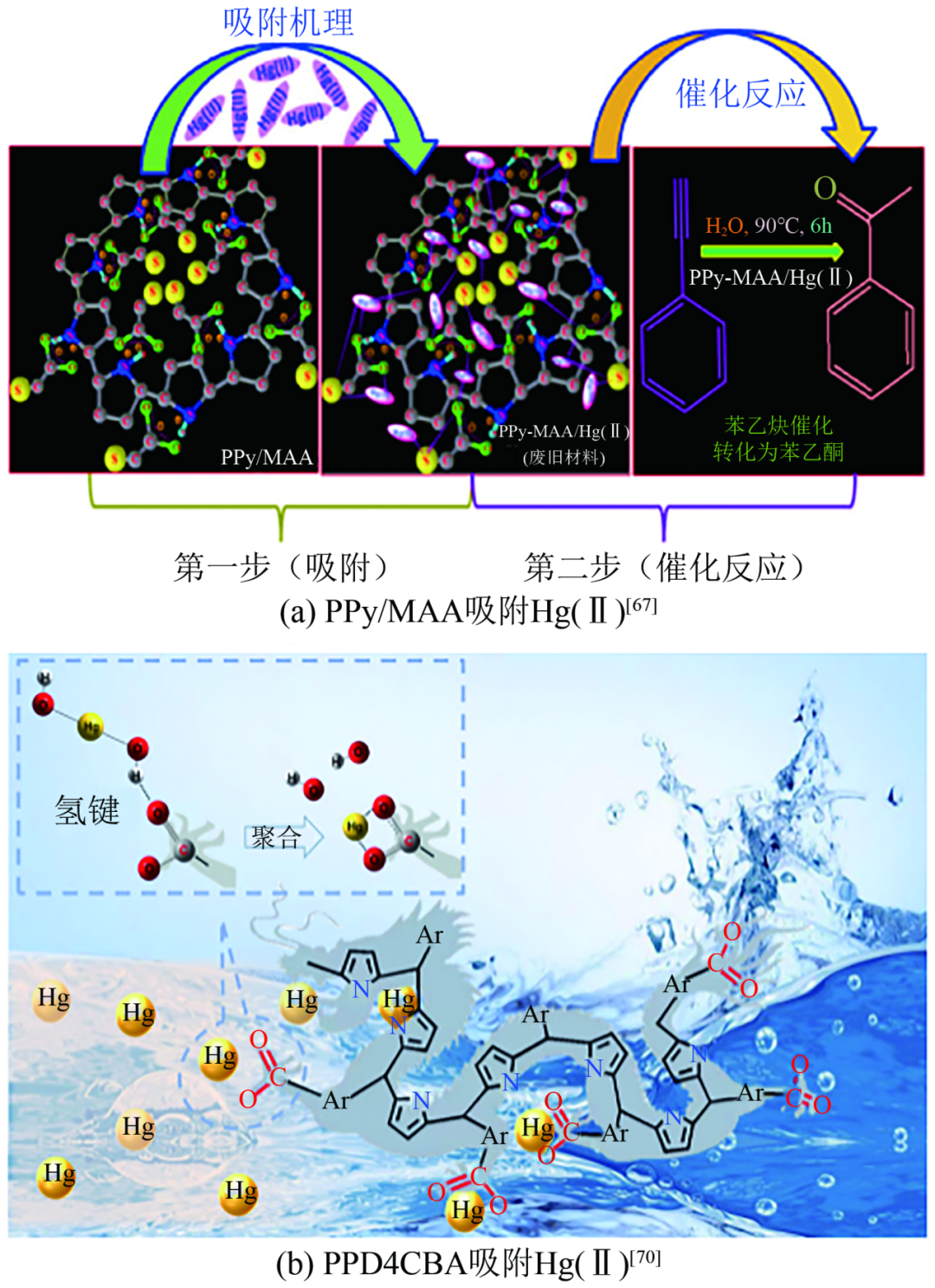
导电聚合物吸附Hg(Ⅱ)
然而导电聚合物也具有一定的缺点,导电聚合物往往比表面积较低,可能会影响Hg(Ⅱ)的吸附容量。导电聚合物的合成过程也较难以控制,例如链状聚合物的排列长度和取向等,无法统一控制。此外,掺杂后的导电聚合物,其掺杂物质与主体导电聚合物之间的结合并不紧密,掺杂物很容易发生脱落,从而降低其对汞离子的吸附性能。重要的是,虽然导电聚合物较为稳定且无毒,但是可能在高温、强氧化或强还原环境下发生分解,从而生成有毒的单体,对环境产生污染。因此就需要选择合适的掺杂方式,确保掺杂物在导电聚合物中均匀分布,减少局部聚集和脱落的风险。也可以选择合适的掺杂物,降低掺杂物与导电聚合物主体之间的界面能量,进而降低脱落的可能性。要想增加导电聚合物的稳定性,降低材料分解产生有毒单体的可能性,就需要控制聚合过程的反应条件,例如避免使用强酸强碱作为催化剂或者温度过高。关于如何控制聚合过程中链状聚合物的排列长度和取向,则需要继续深入研究其反应机制,通过精确控制反应条件来实现其结构控制。
05
二维过渡金属碳(氮)化物
MXenes是在2011年才被研究和报道出来的一类新型二维无机化合物材料,由几个原子层厚度的过渡金属碳化物、氮化物或碳氮化物构成。因其具有与石墨烯相似的二维微观结构,很快就引起了关注。
MXenes的制备过程中会形成新的键,如M—O、M—OH、M—F、M—Cl,从而为吸附金属离子提供了大量的活性位点。同时MXenes具有良好的亲水性和表面负电荷,水溶液中金属阳离子在与之接触时会出现自发的吸附现象。此外,MXenes还具有较大的比表面积和良好的稳定性。这些优良的物化性能使MXenes成为理想的新型金属离子吸附剂。Shahzad等采用水热法制备了层状的磁性Ti3C2Tx-MXenes/Fe3O4复合材料(MGMX)(图9)。Fe3O4纳米颗粒的引入不仅提供了较大的比表面积,而且可以实现材料的高效回收。实验表明,该材料具有明显的亲水性和优异的二价金属离子亲和力,在酸性和碱性条件(pH=3~9)下均表现出优异的汞离子吸附性能,吸附容量达到了1128.41mg/g,而且该材料不受Mg(Ⅱ)、Ca(Ⅱ)等干扰离子的影响,具有高的汞离子选择性,这主要是因为其表面具有大量的—O和—OH以及负电荷。该材料经5次连续吸附-脱附循环重复使用,性能也没有明显下降,表现出良好的去除废水中汞离子的应用潜力。Hu等制备的二维MXenes在30℃时对硝酸汞的吸附容量达到了1057.3mg/g,对氯化汞的吸附容量达到了773.29mg/g。对浓度在100mg/L以内的含汞废水去除率接近100%。该材料主要利用O原子与Hg(Ⅱ)之间的相互作用进行吸附,有良好的选择吸附性。
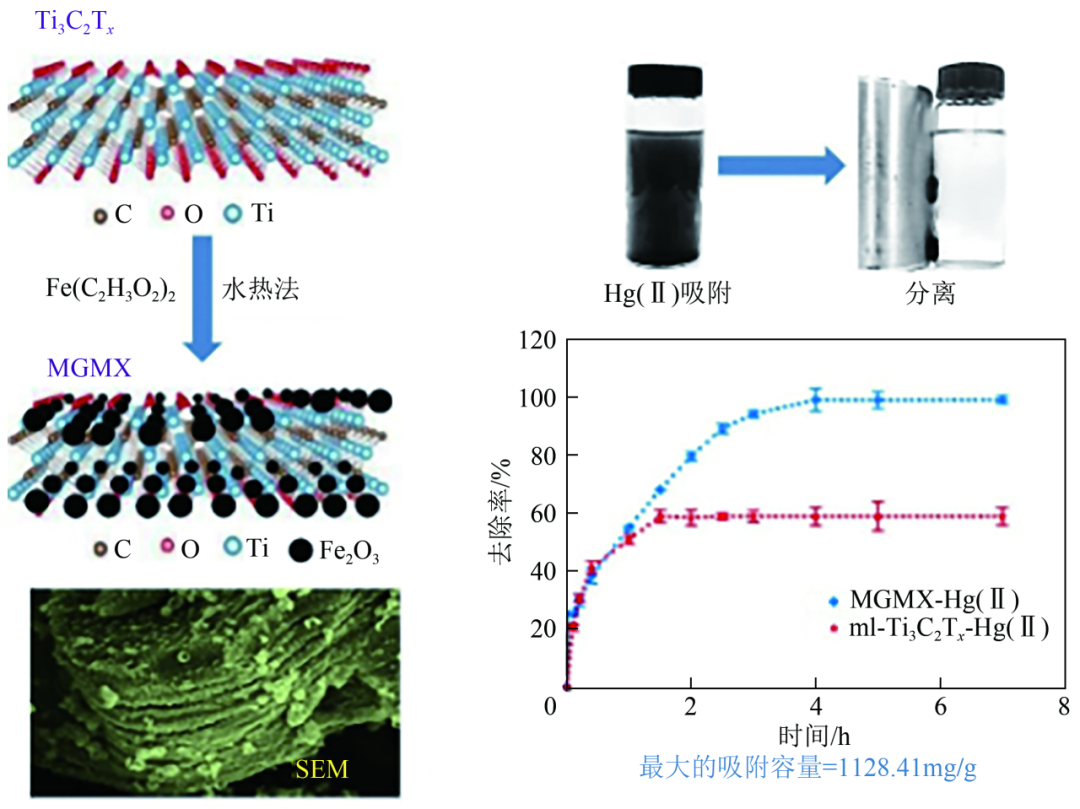
Ti3C2Tx-MXenes/Fe3O4复合材料结构及其对Hg(Ⅱ)的吸附实验
MXenes表面暴露的大量官能团容易被氧化使结构破坏、制备过程危险且容易出现片层堆叠、难制备出少层或单层结构以及机械强度低是MXenes材料发展所面临的主要问题。因此,需要开发出绿色、简单、高效的MXenes材料制备方法,同时实现对表面大量官能团的保护,才能够推动MXenes材料在汞离子吸附方向的进一步发展和大规模工业化应用。
06
复合材料
复合材料是通过人为设计,以一定的形式、比例以及结构分布将物理化学性质不相同的材料进行结合得到的材料。复合材料的各单体材料组分不会损失原有的特性,而是相互结合,协同作用,从而提高复合材料的性能。使得复合材料不仅具有单组分材料的优点,而且还能够获得单种材料所不具备的一些特性,从而弥补原有单种吸附材料的不足,达到更好的吸附效果或更有利于实际应用。
有机材料与纳米材料复合,既能够发挥有机材料的可调节性,又能够引入与汞离子具有较高亲和力的新元素(如S、Se等),同时具有纳米材料的高比表面积的特点,使更多的活性基团得以暴露和利用。Liang等将In2S3纳米颗粒引入MIL-101中,开发出新型MIL基复合材料(In2S3@MIL-101),该复合材料不仅具有较大的吸附容量(518.0mg/g),而且可以在1min内从废水中去除99.95%的Hg(Ⅱ)[图10(a)],对汞吸附的分配系数(Kd)达到了2.2×107mL/g,具有快速的吸附动力学特性。采用0.1mol/L的KCl溶液和去离子水进行洗涤脱附,3次循环后几乎保持原有的Hg(Ⅱ)去除效率。Zhao等将纳米硒与碳纳米纤维气凝胶进行复合,形成了三维互连网络的无定型Se/CNF材料[图10(b)]。在吸附汞的过程中,Se的利用率高达99.5%。45℃时对Hg(Ⅱ)的最大吸附容量为943.4mg/g。在吸附过程中,气凝胶中的C==O能够起到提供电子的作用从而促进吸附。吸附后的材料,Se和Hg的浸出量均达到USEPA要求,能够直接进行填埋处理。当然,经过1mol/L的KI和0.1mol/L的I2混合溶液脱附处理后也能够多次利用,3次循环后,吸附容量仍保持在初始值的90%以上。
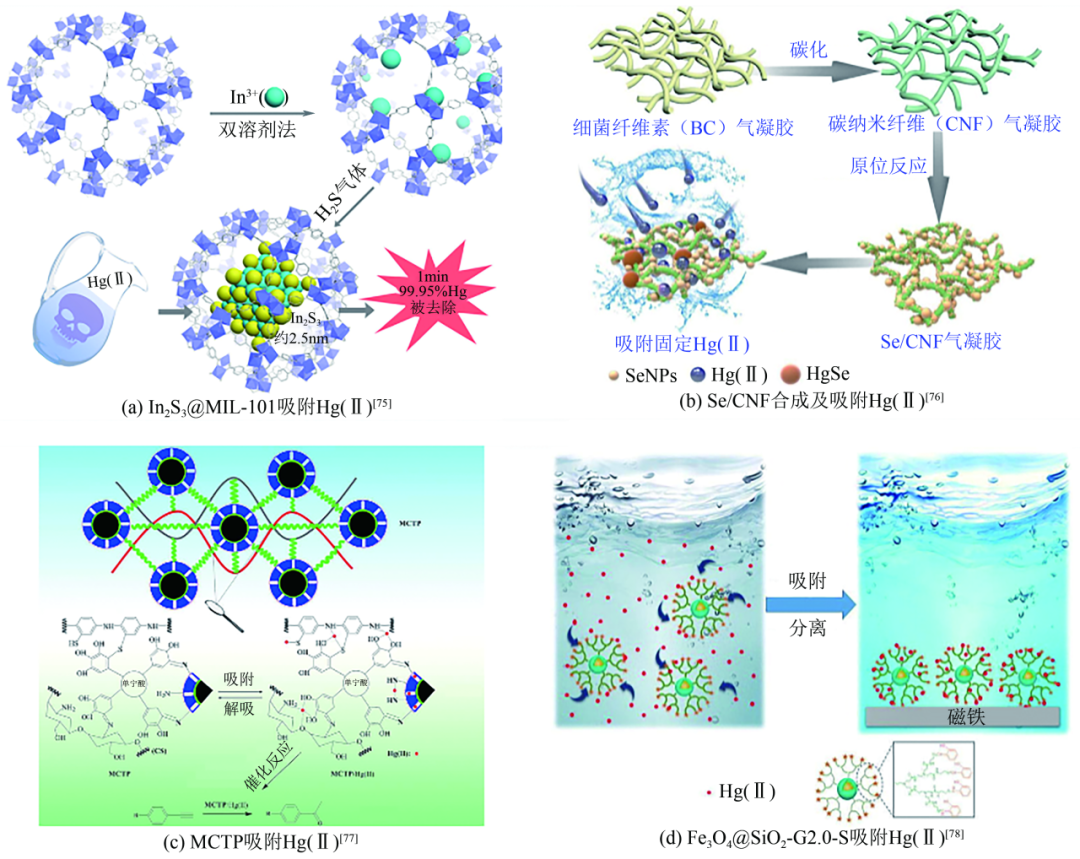
复合材料吸附Hg(Ⅱ)
一般的有机材料,在实际应用中会存在回收较为困难的问题。有机材料与磁性物质进行复合,就能够很好解决这一问题。利用材料的磁性,能够在吸附后快速地将吸附剂与水分离。Fu等将聚氨基硫酚和壳聚糖引入磁性介孔纳米颗粒上,构建了一种新型的磁性网络聚合物复合材料(MCTP)[图10(c)],对Hg(Ⅱ)的最大吸附容量为515.46mg/g。MCTP对水体中Hg(Ⅱ)具有快速的吸附动力学特性。在汞离子初始浓度为100mg/L时,15min内对Hg(Ⅱ)的去除率达到了98.16%。2020年Zhou等通过Schiff碱修饰聚酰胺胺(PAMAM)树枝状聚合物与磁性Fe3O4复合所制备的Fe3O4@SiO2-G2.0-S复合材料通过N原子与Hg(Ⅱ)结合[图10(d)],对Hg(Ⅱ)的最大吸附容量为605.8mg/g,能够在180min内达到吸附平衡,同时能在溶液中多种重金属离子存在的情况下百分之百地选择吸附Hg(Ⅱ)。用0.5mol/L的硝酸和5%的硫脲混合溶液进行脱附,5次循环后,对Hg(Ⅱ)去除率仍然高于91%。
复合材料通常能够结合多种材料的优点,但是也存在一定的缺点:①制备的复杂性,复合材料的制备可能需要复杂的多步过程,这增加了材料制备的难度和成本;②材料的稳定性,复合材料可能在长期的吸附-解吸过程中发生损伤和结构破坏,从而导致吸附效果下降以及机械强度下降,发生材料坍塌;③材料的吸附容量不高,因为复合材料更多是为了调节材料结构或实际应用,所以经常加入一些在吸附过程中无法提供Hg(Ⅱ)吸附位点的材料,这就使得单位质量吸附剂中,实际起到吸附作用的材料占比下降,从而降低了材料的吸附容量。要想找出优秀的复合材料就需要研究出简便的合成方法,降低合成难度和成本;选择化学稳定性、热稳定性以及机械强度较高的材料进行复合,延长其在实际使用中的寿命;同时这些材料还需要具有良好孔隙结构和低密度,来保证材料的吸附容量。这样才能够使复合材料吸附剂适应于更多的场景中,在实际应用中切实发挥作用。
07
吸附机理
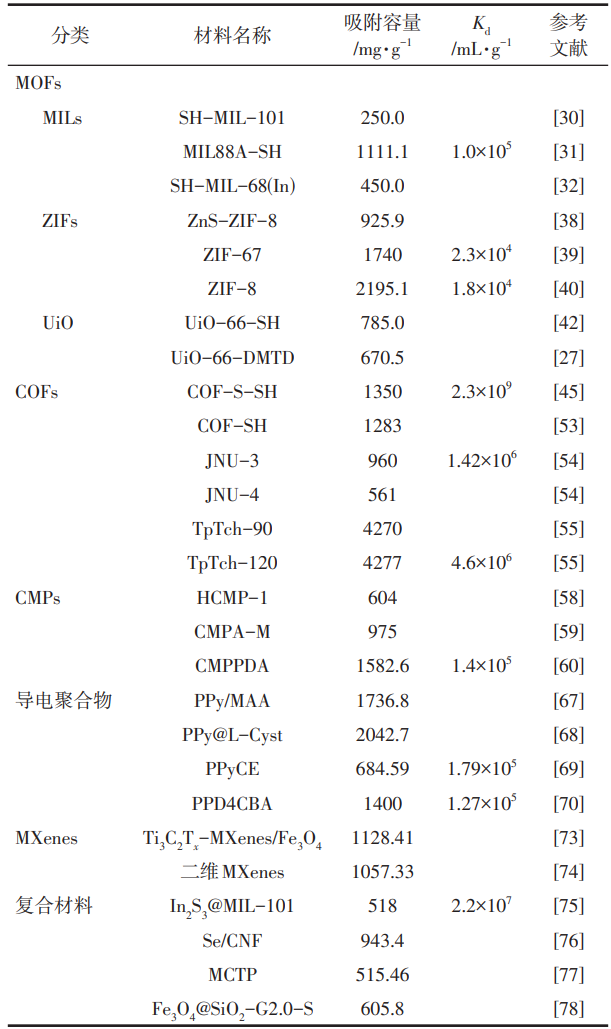
不同的材料具有不同的吸附性能(表4),其吸附机理也不尽相同。吸附法的作用机理分为物理吸附和化学吸附两种。其中物理吸附是Hg(Ⅱ)与吸附剂之间通过范德华力或静电力等相互作用而发生的吸附。化学吸附是指Hg(Ⅱ)与吸附剂表面的原子(或者分子)发生电子转移、交换或共用,形成化学键而发生的吸附。与物理吸附不同,化学吸附涉及化学键形成和断裂,因此该吸附过程常常涉及更强的相互作用。
表4 不同材料的吸附性能
范德华力是一种分子间的弱相互吸引力,随着分子间距离的增加而减弱。当Hg(Ⅱ)靠近吸附剂表面时,由于吸附剂表面的分子与Hg(Ⅱ)之间的范德华力,物质分子会被吸附在表面上。由于范德华力属于弱相互作用力,所以其对Hg(Ⅱ)的吸附容量有一定的限制,一般不会有大量的Hg(Ⅱ)通过范德华力吸附。静电力吸附是Hg(Ⅱ)与带有相反电荷的吸附剂之间由于异种电荷相互吸引而结合吸附的一种机制。当溶液的pH大于吸附剂自身等电点时,吸附剂本身会带有一定量的负电荷,从而与带有正电荷的Hg(Ⅱ)产生静电相互作用进行吸附。
化学吸附的作用力主要有共价作用、配位作用以及螯合作用等。共价作用是Hg(Ⅱ)与吸附剂表面形成共价键,这种作用一般结合较为牢固,需要较大的能量才能够破坏。配位作用是Hg(Ⅱ)与吸附剂之间形成一种化学键,不是共价键,吸附剂提供电子对,Hg(Ⅱ)作为电子受体形成配位键,比物理吸附更加牢固但比共价键的吸附更容易被破坏。螯合作用是Hg(Ⅱ)与同一个吸附剂分子上的两个或多个原子之间形成配位键,进而连接成一个杂环结构的作用。
08
结语
汞污染治理问题迫在眉睫,如何找到吸附容量大、平衡时间短、选择吸附性好、稳定性高、原料廉价易得的吸附材料,是吸附法去除水中汞离子的关键。本文综述了关于环境水体中的新型汞离子吸附材料,包括金属有机骨架材料、共价有机框架材料、共轭微孔聚合物、导电聚合物、二维过渡金属碳(氮)化物和复合材料等。不同的材料具有不同的特点和优势,但均具有作为汞离子吸附材料的潜力。
然而,原始的基础材料往往对汞离子吸附效果并不理想,这就需要对它们进行改性,在保持原有材料特性的基础上提高吸附性能。可以从以下三个方面进行研究。
(1)改变材料合成过程中的原料以及合成条件,调节材料的孔隙结构和比表面积,将更多的活性基团暴露,为Hg(Ⅱ)提供更多的吸附位点,同时促进Hg(Ⅱ)在材料孔隙中的扩散,提高吸附速率。
(2)特定的官能团是提升吸附性能的关键。在材料合成过程中添加含有S(如巯基、磺基等)或者N(如氨基、亚氨基等)的官能团,能够显著提高材料与Hg(Ⅱ)之间的亲和力,提高材料的吸附容量,同时增强材料对Hg(Ⅱ)的选择吸附性,可以从水中特异性吸附Hg(Ⅱ)。
(3)将多种特性材料进行复合,得到性能优异的吸附剂材料。
作者简介

第一作者:张爱京,硕士研究生,研究方向为环境吸附材料设计。
通信作者:冯江涛,教授,博士生导师,研究方向为环境吸附材料设计。



